Explorando el arsenal molecular de los parásitos de los peces
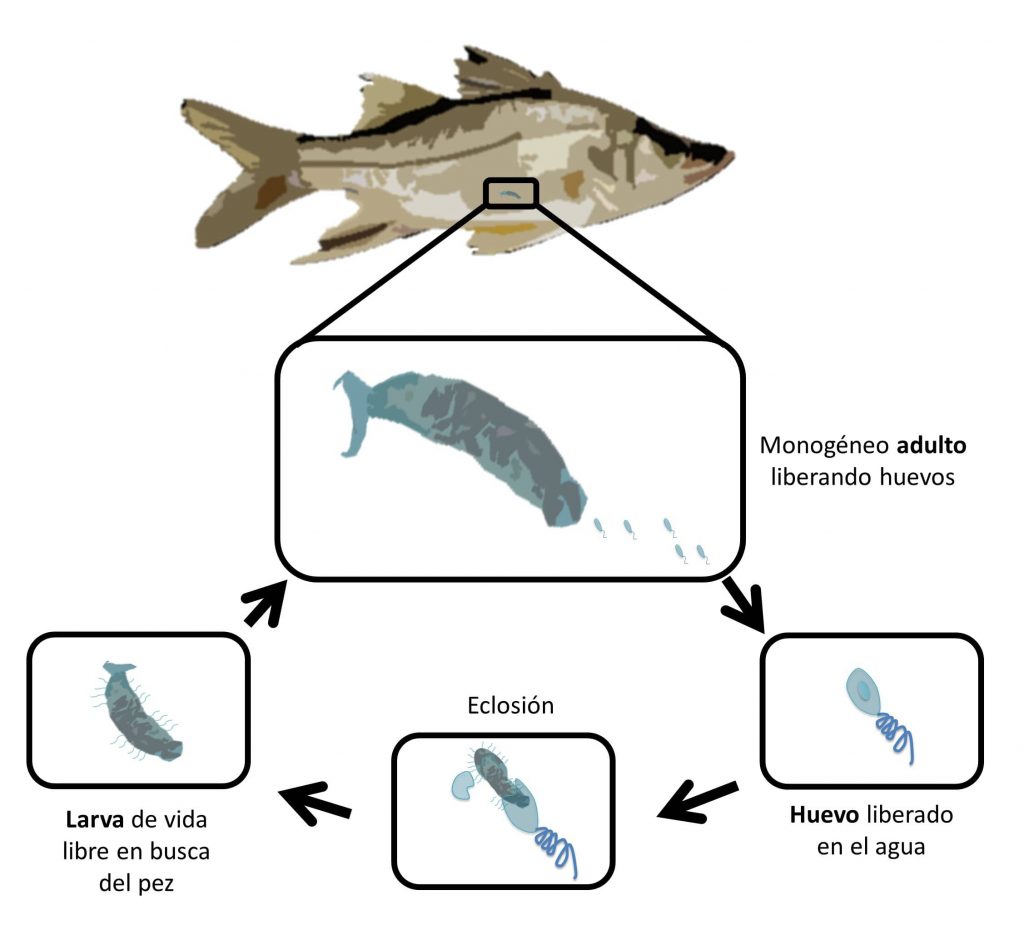
Los monogéneos son gusanos pequeños que infectan principalmente las branquias, piel y aletas de los peces, aunque también podemos encontrar monogéneos en otros animales. Estos parásitos son hermafroditas, lo que significa que un individuo es hembra y macho al mismo tiempo (poseen órganos reproductivos femeninos y masculinos). Para reproducirse, los monogéneos frecuentemente deben cruzarse, pero también, en algunas especies, un solo individuo es capaz de autofecundarse (Hoai y Hutson, 2014). Así, un solo monogéneo es capaz de generar cientos o miles de huevos en pocos días. Los huevos son liberados en el agua y de cada huevo sale una larva que nada libremente hasta encontrar a un pez; los que no lo logran mueren. Una vez en el pez, la larva se desarrolla en adulto y se reproduce (Hoai y Hutson, 2014).
Sin embargo, no todos los monogéneos producen huevos, ya que algunos son vivíparos (Ogawa, 2015), y son capaces de reproducirse de manera explosiva en las poblaciones de peces en cautiverio. Para algunas especies, el tiempo de desarrollo desde huevo hasta adulto puede ser aproximadamente de dos semanas, incluso menos (Hoai y Hutson, 2014). Este tiempo depende mucho de la temperatura del agua. El desarrollo es más rápido al aumentar la temperatura (Ogawa, 2015). Entonces, si tomamos en cuenta que un monogéneo se reproduce por cientos y miles y que estos lo hacen igualmente, podríamos esperar un brote parasitario en los estanques o jaulas de cultivo, porque ahí hay muchos peces encerrados.
Algunas especies de monogéneos se alimentan de sangre, mientras que otras del moco que se encuentra en la piel o branquias de los peces (Ogawa, 2015). Para poder alimentarse, los monogéneos necesitan permanecer pegados a los peces, lo cual logran con unos ganchos poderosos que, por supuesto, provocan lesiones al pez. Si hay muchos individuos, las lesiones se vuelven graves y se presentan problemas respiratorios, irritación, anemia e, incluso, la muerte (Ogawa, 2015; Grano-Maldonado et al., 2018).
Los costos de los tratamientos más los peces muertos representan pérdidas económicas para los productores. Uno de los monogéneos más perjudiciales es Gyrodactylus salaris, responsable de daños catastróficos en los cultivos de salmón, principalmente en Europa. En México, los monogéneos han afectado el cultivo de peces de agua dulce. Por ejemplo, en Sinaloa, un grupo de investigadores registró la mortalidad masiva de tilapia causada por el monogéneo Gyrodactylus cichlidarum (Grano-Maldonado et al., 2018). En Tamaulipas, el crecimiento del bagre de canal ha sido afectado negativamente por Ligictaluridus floridanus (Rábago-Castro et al., 2014). En el centro del país, la trucha arco iris ha sido afectada por Gyrodactylus salmonis. Asimismo, los monogéneos Neobenedenia y Rhabdosynochus han causado problemas en la producción de peces marinos, como los jureles y robalos (Ogawa, 2015; Caña-Bozada et al., 2021a).
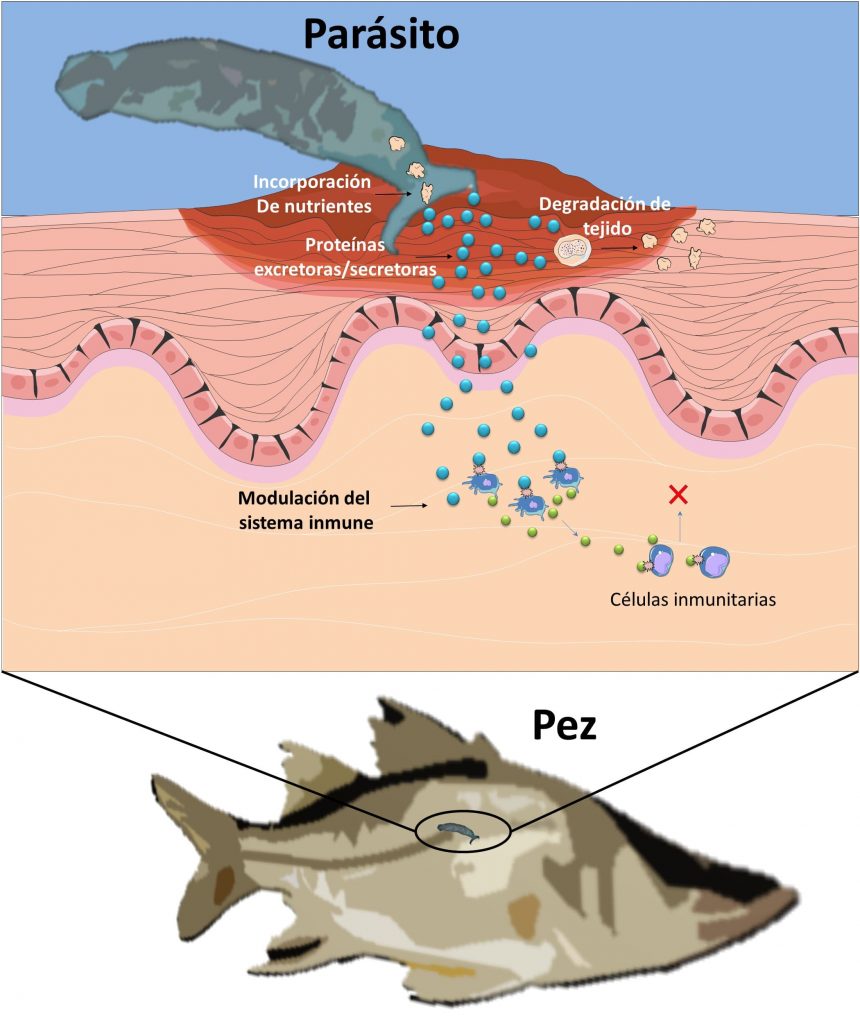
Proteínas excretoras/secretoras (PES)
Los parásitos usan sus PES (proteínas excretoras/secretoras) para infectar a un determinado organismo. Algunas PES son usadas para localizar al organismo, otras para “burlar” sus defensas y otras para digerir el alimento (Sajid y McKerrow, 2002). Por ejemplo, el gusano Fasciola gigantica, un endoparásito, usa algunas de sus PES para alimentarse de la sangre del humano y también del ganado (Chantree et al., 2012). De igual manera, el gusano Clonorchis sinensis, otro endoparásito, usa algunas PES para tomar nutrientes del humano (Liang et al., 2014). Para conocer más detalles de estos parásitos se puede consultar el artículo escrito por Sajid y McKerrow (2002), publicado en la revista Biochemical Parasitology.
Las PES, al estar fuera de la célula, pueden ser alcanzadas más fácilmente por un fármaco. En las especies Schistosoma mansoni, Echinococcus multilocularis, Taenia solium y Fasciola hepatica, que son endoparásitos de humanos y animales, se han realizado varias investigaciones para encontrar PES que puedan ser atacadas por medicamentos.
Las PES que se están buscando deben ser indispensables para la vida del parásito. De esta manera, podríamos eliminar parásitos cuando sus PES indispensables sean atacadas con algún compuesto. Entre las PES propuestas están algunas catepsinas, serinas y proteínas de choque térmico. Por ejemplo, Conor R. Caffrey y otros investigadores de la Universidad de California, mediante experimentos con ratones infectados con Schistosoma mansoni, observaron que el número de parásitos disminuyó al aplicar un fármaco que ataca a una de sus PES (Abdulla et al., 2007).
PES en monógenos
A diferencia de los endoparásitos del ser humano y del ganado, sabemos muy poco de las PES de los ectoparásitos de peces. Por lo tanto, en el Centro de Investigación en Alimentación y Desarrollo (CIAD), gracias al financiamiento del Consejo Nacional de Ciencia y Tecnología (proyecto Ciencia de Frontera No. 1715616), desarrolla un proyecto para identificar las PES de monogéneos. Los primeros resultados indican que los monogéneos tienen cientos de PES. En Gyrodactylus salaris, se han encontrado quince que parecen indispensables para mantener vivo al parásito (Caña-Bozada et al., 2021b).
Actualmente, se siguen generando y analizando datos para tener resultados más específicos. Una de las partes más desafiantes de este proyecto es el desarrollo de experimentos para comprobar la función de algunas PES de monogéneos.
Para enfrentar este y otros desafíos, se han emprendido colaboraciones con investigadores de otras instituciones mexicanas, como el Instituto Potosino de Investigación Científica y Tecnológica y la Universidad Nacional Autónoma de México.
Con este proyecto, se espera generar conocimiento científico que favorezca a la producción de peces. El control efectivo de parásitos en este sector es importante para contrarrestar las presiones sociales y económicas que demandan una producción más eficiente y sostenible, asegurando el bienestar animal.
Referencias
Abdulla, M. H., Lim, K. C., Sajid, M., McKerrow, J. H. y Caffrey, C. R. (2007). Schistosomiasis mansoni: novel chemotherapy using a cysteine protease inhibitor. PLoS Medicine, 4(1): e14.
Caña-Bozada, V., Llera-Herrera, R., Fajer-Ávila, E. J. y Morales-Serna, F. N. (2021a). Mitochondrial genome of Rhabdosynochus viridisi (Monogenea: Diplectanidae), a parasite of Pacific white snook Centropomus viridis. Journal of Helminthology, 95: E21.
Caña-Bozada, V., Chapa-López, M., Díaz-Martín, R. D., García-Gasca, A., Huerta Ocampo, J. Á., de Anda-Jáuregui, G. y Morales-Serna, F. N. (2021b). In silico identification of excretory/secretory proteins and drug targets in monogenean parasites. Infection, Genetics and Evolution, 93: 104931.
Chantree, P., Wanichanon, C., Phatsara, M., Meemon, K. y Sobhon, P. (2012). Characterization and expression of cathepsin B2 in Fasciola gigantica. Experimental Parasitology, 132: 249-256.
Grano-Maldonado, M. I., Rodríguez-Santiago, M. A., García-Vargas, F., Nieves-Soto, M. y Soares, F. (2018). An emerging infection caused by Gyrodactylus cichlidarum
Paperna, 1968 (Monogenea: Gyrodactylidae) associated with massive mortality on farmed
Tilapia Oreochromis niloticus (L.) on the Mexican Pacific coast. Latin American Journal of Aquatic Research, 46(5): 961-968.
Hoai, T. D. y Hutson, K. S. (2014). Reproductive strategies of the insidious fish ectoparasite, Neobenedenia sp. (Capsalidae: Monogenea). PLoS ONE, 9(9): e108801.
Liang, P., He, L., Xu, Y., Chen, X., Huang, Y., Ren, M., Liang, C., Li, X. R., Xu, J., Lu, G. y Yu, X. (2014). Identification, immunolocalization, and characterization analyses of an exopeptidase of papain superfamily, (cathepsin C) from Clonorchis sinensis. Parasitology Research, 113: 3621-3629.
Ogawa, M. K. (2015). Diseases of cultured marine fishes caused by Platyhelminthes (Monogenea, Digenea, Cestoda). Parasitology,142 (1): 178-195.
Rábago-Castro, J. L., Sánchez-Martínez, J. G., Pérez-Castañeda, R., Vázquez-Sauceda, M. L. y Ruiz-Orozco, G. (2014). Chronic effects of a monogenean Ligictaluridus floridanus (Ancyrocephalidae) infection on channel catfish (Ictalurus punctatus) growth performance. Acta Veterinaria Brno, 83(2): 83-87.
Sajid, M. y McKerrow, J. H. (2002). Cysteine proteases of parasitic organisms.
Molecular and Biochemical Parasitology, 120: 1-21.
Colaboración de Víctor Hugo Caña Bozada, estudiante del doctorado en ciencias en la Coordinación Regional Mazatlán del CIAD, y Francisco Neptalí Morales Serna, investigador del Instituto de Ciencias del Mar y Limnología, de la Universidad Nacional Autónoma de México